O que é o Vectibix?
Vectibix é um concentrado para ser reconstituído em solução para perfusão (gota a gota) contendo a substância ativa panitumumab.
Para que é utilizado o Vectibix?
Vectibix é indicado para o tratamento de pacientes com carcinoma colorretal metastático, um tumor do intestino grosso que se espalhou para outras partes do corpo. O Vectibix é utilizado isoladamente (sozinho) em doentes cujas células tumorais possuem uma proteína denominada receptor do factor de crescimento epidérmico (EGFR) na superfície e contêm um gene " KRAS " não mutado . O KRAS é um gene que, quando mutado nas células cancerígenas, estimula o crescimento do tumor. Vectibix é utilizado quando os regimes de tratamento com combinações de medicamentos anticancerígenos, incluindo "fluoropirimidina" (por exemplo, 5-fluorouracil), oxaliplatina e irinotecano, já não são eficazes.
O medicamento só pode ser obtido mediante receita médica.
Como o Vectibix é usado?
O tratamento com Vectibix deve ser realizado sob a supervisão de um médico especializado no uso de tratamento contra o cancro. A terapêutica só deve ser iniciada após a detecção da expressão de KRAS inalterada por um laboratório com experiência adequada, utilizando métodos fiáveis.
A dose recomendada de Vectibix é de 6 mg / kg de peso corporal, administrada uma vez a cada duas semanas, em perfusão. A duração recomendada da infusão é de cerca de 60 minutos, mas doses mais elevadas podem demorar 90 minutos.
Como o Vectibix funciona?
A substância ativa do Vectibix, o panitumumab, é um anticorpo monoclonal. Um anticorpo monoclonal é um anticorpo (um tipo de proteína) projetado para reconhecer e se ligar a uma estrutura específica (antígeno) presente em certas células do corpo. O panitumumab foi criado para se ligar ao EGFR, um receptor localizado na superfície de certas células, incluindo células de certos tumores. Como resultado, as células tumorais não recebem mais as mensagens necessárias para seu crescimento, progressão e difusão (metástases) transmitidas pelo EGFR. O panitumumab parece não funcionar nas células tumorais que contêm o gene KRAS mutado, porque o crescimento dessas células não é
controlado por sinais transmitidos via EGFR, em seguida, continuar a crescer mesmo após a inibição do receptor EGFR.
Quais estudos foram realizados no Vectibix?
Os efeitos do Vectibix foram testados em modelos experimentais antes de serem estudados em seres humanos.
O Vectibix foi estudado num estudo principal que incluiu um total de 463 doentes com cancro do cólon ou rectal, nos quais a doença foi agravada durante ou após terapêutica anterior com fluoropirimidina, oxaliplatina e irinotecano. A eficácia de Vectibix associada à "melhor terapia de suporte" foi comparada com a da "melhor terapia de suporte" isolada. A melhor terapia de suporte é qualquer medicação ou técnica que possa ajudar o paciente, como antibióticos, analgésicos, transfusões e cirurgias, com exceção de outros medicamentos antineoplásicos. O principal parâmetro de eficácia foi o tempo gasto até a doença se agravar ou o doente morrer. Os resultados do estudo foram analisados separadamente em 243 pacientes cujo tumor teve o gene KRAS não mutado e em 184 pacientes nos quais foi observada uma mutação no gene KRAS .
Qual o benefício demonstrado pelo Vectibix durante os estudos?
Nos doentes cujos tumores tinham KRAS inalterado, Vectibix prolongou o período de tempo antes da progressão da doença ou morte do doente: em doentes tratados com Vectibix associada à melhor terapêutica de suporte, o tempo médio registado foi de 12, 3 semanas, enquanto nos sujeitos em tratamento com a única melhor terapia de suporte, os dados coletados foram de 7, 3 semanas. Em contraste, não houve efeito positivo de Vectibix em pacientes com tumores caracterizados por KRAS mutado: neste caso, o intervalo de tempo médio antes da progressão ou morte foi de aproximadamente 7, 3 semanas em ambos os grupos de pacientes. pacientes.
Qual é o risco associado ao Vectibix?
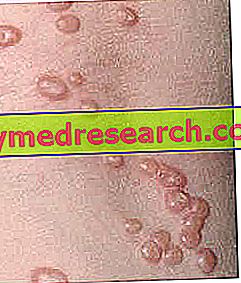
Em cerca de 90% dos doentes tratados com Vectibix existem efeitos indesejáveis na pele, principalmente ligeiros a moderados. Os efeitos secundários mais frequentes associados ao Vectibix (observados em mais de 1 em cada 10 doentes) são erupção cutânea, dermatite acneiforme (inflamação da pele semelhante a uma acne), eritema (descamação da pele), descamação da pele, comichão, pele seca, fissuras cutânea (rachadura da pele), paroníquia (infecção do tecido ao redor da unha), diarréia, fadiga, náusea, vômito, dispneia (dificuldade para respirar) e tosse. Para a lista completa dos efeitos secundários comunicados relativamente ao Vectibix, consulte o Folheto Informativo.
O Vectibix não deve ser utilizado em pessoas que possam ser hipersensíveis (alérgicas) ao panitumumab ou a qualquer outro componente do medicamento. Também não deve ser usado em pacientes com pneumonia intersticial ou fibrose pulmonar (doença pulmonar).
Por que a Vectibix foi aprovada?
O Comité dos Medicamentos para Uso Humano (CHMP) concluiu que os benefícios do Vectibix são superiores aos seus riscos no tratamento em monoterapia de doentes com carcinoma colo-rectal metastático que expressam o receptor do factor de crescimento epidémico (EGFR) após falha do regimes quimioterapêuticos contendo fluoropirimidina, oxaliplatina e irinotecano, caso os tumores apresentem o gene KRAS não mutado ( tipo selvagem ). Por conseguinte, o Comité recomendou a concessão de uma autorização de introdução no mercado para o Vectibix.
Vectibix obteve uma "aprovação condicional". Isso significa que mais informações sobre o medicamento devem ser apresentadas, especialmente em relação à segurança e eficácia em pacientes com tumores contendo KRAS inalterado . A Agência Européia de Medicamentos (EMEA) revisará anualmente qualquer nova informação disponível e, se necessário, este resumo será atualizado.
Quais informações ainda são aguardadas pela Vectibix?
O fabricante de Vectibix fornecerá os resultados de estudos adicionais sobre a segurança e eficácia do medicamento em doentes com cancro colo-rectal com e sem KRAS e a qualidade de vida dos doentes em tratamento com o medicamento. Estes incluem estudos para avaliar o uso de Vectibix em combinação com outras drogas, tanto em pacientes que já foram submetidos a tratamento no passado e em pacientes que nunca foram tratados para o câncer, bem como um estudo projetado para para confirmar a eficácia de Vectibix administrado isoladamente com a dose aprovada.
Mais informações sobre o Vectibix:
Em 3 de Dezembro de 2007, a Comissão Europeia concedeu uma Autorização de Introdução no Mercado, válida em toda a União Europeia, para a Vectibix, à Amgen Europe BV.
Para a versão completa do EPAR do Vectibix, clique aqui.
Última atualização deste resumo: 03-2009.