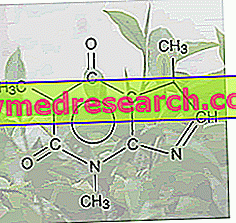
O que é Fampyra - fampridine?
O Fampyra é um medicamento que contém a substância ativa fampridina. O medicamento está disponível na forma de comprimidos de libertação prolongada (10 mg).
O que é Fampyra - fampridine usado para?
Fampyra é indicado para a melhora da marcha em pacientes adultos com esclerose múltipla (EM) com deficiência motora.
A esclerose múltipla é uma doença inflamatória que afeta o sistema nervoso, com uma destruição progressiva da bainha protetora que cobre os nervos.
O medicamento só pode ser obtido mediante receita médica.
Como é que Fampyra - fampridine é usado?
O tratamento com Fampyra só deve ser realizado sob a supervisão e supervisão de médicos com experiência no tratamento da esclerose múltipla. A dose recomendada é de um comprimido tomado por via oral, duas vezes por dia, com 12 horas de intervalo. Os comprimidos devem ser tomados em jejum.
Os pacientes devem ser examinados após duas semanas de tratamento; o tratamento deve ser interrompido se não houver melhora. O tratamento também deve ser interrompido se a capacidade de andar piorar ou se o paciente não relatar se beneficiar do tratamento.
Como funciona Fampyra - fampridina?
Os músculos do organismo se contraem porque recebem impulsos elétricos que são transmitidos pelo sistema nervoso. Na esclerose múltipla, a transmissão de impulsos elétricos é comprometida quando a bainha de proteção que cobre os nervos é danificada. Isso resulta em fraqueza muscular, rigidez muscular e dificuldade em andar.
A substância activa do Fampyra, a fampridina, é um bloqueador dos canais de potássio. Atua nas estruturas nervosas danificadas, impedindo que as partículas de potássio carregadas deixem as células nervosas. Acredita-se que, desta forma, produz o efeito de permitir que o impulso elétrico continue a se propagar ao longo do sistema nervoso para estimular o músculo, facilitando a caminhada.
Quais estudos foram realizados no Fampyra - fampridine?
Os efeitos do Fampyra foram testados em modelos experimentais antes de serem estudados em seres humanos. A empresa também apresentou dados da literatura científica.
Dois grandes estudos foram realizados em que Fampyra foi comparado com placebo (uma substância sem efeito sobre o corpo) em 540 pacientes com esclerose múltipla. Os pacientes foram tratados por 9 ou 14 semanas. O principal parâmetro de eficácia foi representado por melhorias na velocidade de marcha ao longo de uma distância de cerca de 7, 5 metros. Esperava-se que os pacientes respondessem ao tratamento se, pelo menos em três de quatro vezes, sua velocidade de caminhada fosse maior que a velocidade máxima registrada antes do tratamento.
Qual o benefício demonstrado pelo Fampyra - fampridine durante os estudos?
Fampyra foi eficaz na melhoria da velocidade de caminhada. Num dos principais estudos, cerca de 35% dos doentes tratados com Fampyra responderam ao tratamento, em comparação com 8% dos doentes tratados com placebo. O segundo estudo mostrou resultados semelhantes: 43% dos pacientes no grupo Fampyra responderam ao tratamento em comparação com 9% dos pacientes no grupo placebo.
Qual é o risco associado ao Fampyra - fampridine?
Os efeitos secundários mais frequentes associados ao Fampyra são principalmente neurológicos (ie detectáveis a nível nervoso ou cerebral), nomeadamente convulsões, insónia, ansiedade, problemas de equilíbrio, tonturas, parestesias (sensações anormais como formigueiro e formigueiro), tremores, de cabeça e astenia (fraqueza). O efeito colateral mais comum relatado em estudos clínicos, que afeta cerca de 12% dos pacientes, é a infecção do trato urinário. Para a lista completa dos efeitos secundários comunicados relativamente ao Fampyra, consulte o Folheto Informativo.
O Fampyra não deve ser utilizado em pessoas que possam ser hipersensíveis (alérgicas) à fampridina ou a qualquer outro componente do medicamento. Não deve ser utilizado com outros medicamentos que contenham fampridina ou medicamentos conhecidos como "inibidores de catiões orgânicos 2", tais como a cimetidina. Fampyra não pode ser usado em pacientes que tenham ou tenham tido convulsões no passado ou em pacientes com problemas renais.
Por que o Fampyra - fampridine foi aprovado?
O CHMP considera provável que o Fampyra beneficie aproximadamente um terço dos doentes com EM com incapacidade de andar e que estes benefícios possam ser identificados nestes indivíduos numa fase inicial do tratamento, o que permite que o tratamento seja interrompido noutros indivíduos. O Comitê observou que nenhum outro tratamento está atualmente autorizado para o tratamento de sintomas de esclerose múltipla e que os efeitos colaterais graves com o Fampyra são uma ocorrência rara. Por conseguinte, o CHMP concluiu que os benefícios do Fampyra são superiores aos seus riscos para os doentes com deficiência da marcha e recomendou a concessão de uma autorização de introdução no mercado para este medicamento.
Fampyra obteve "aprovação condicional". Isso significa que mais dados são esperados, particularmente no que diz respeito aos efeitos a longo prazo da droga sobre outros aspectos da capacidade de locomoção. A Agência Europeia de Medicamentos irá rever anualmente a nova informação disponível e, se necessário, actualizar este resumo.
Quais medidas estão sendo tomadas para garantir o uso seguro de Fampyra - fampridine?
A empresa que produz o Fampyra realizará um estudo de longo prazo sobre a eficácia e segurança do medicamento. O estudo examinará os efeitos do Fampyra em outros aspectos da marcha, além da velocidade, e encontrará novas maneiras de identificar os pacientes que respondem ao Fampyra cedo, para permitir uma intervenção imediata no tratamento do tratamento.
Outras informações sobre Fampyra - fampridine
Em 20 de julho de 2011, a Comissão Europeia concedeu uma Autorização de Introdução no Mercado, válida para Fampyra, válida em toda a União Europeia.
Para mais informações sobre o tratamento com o Fampyra, leia o Folheto Informativo (também parte do EPAR) ou contacte o seu médico ou farmacêutico.
Última atualização deste resumo: 06-2011.