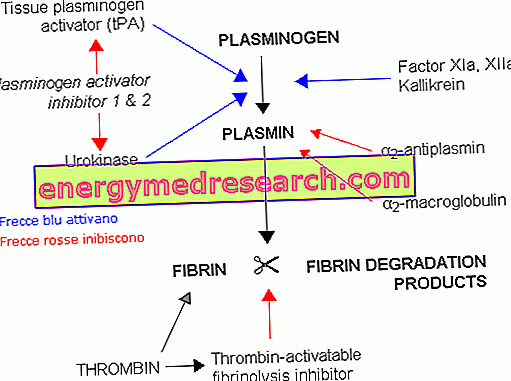
A plasmina é a enzima proeminente do sistema fibrinolítico, um processo biológico usado para dissolver coágulos de fibrina formados como resultado de lesões vasculares. Estes intrincados polímeros de fibrina destinam-se a criar uma espécie de cápsula anti-hemorrágica, que incorpora as células sanguíneas (plaquetas, glóbulos brancos e glóbulos vermelhos) e várias proteínas plasmáticas. Entre eles também está o precursor inativo da plasmina, chamado plasminogênio, que tem alta afinidade pelas moléculas de fibrina. Graças a essa característica, o plasminogênio é concentrado sobretudo nos locais de armazenamento de fibrina (como coágulos).
O plasminogênio é convertido em plasmina pela intervenção de ativadores naturais específicos, incluindo a uroquinase (u-PA) e o ativador do plasminogênio tecidual (t-PA). Apesar do nome, este último é mais ativo no nível circulatório (geralmente é secretado muito lentamente para permitir os processos de reparo da lesão), enquanto a uroquinase é mais ativa no nível tecidual. Portanto, similarmente ao que foi observado para a coagulação, na fibrinólise é possível distinguir uma via intrínseca e uma via extrínseca, ambas consistindo de uma série de reações em cascata.
O sistema fibrinolítico limita o dano decorrente da deposição excessiva de fibrina e a consequente obstrução dos vasos, devido a coágulos anormais (chamados trombos).
Com um mecanismo proteolítico, a plasmina recém-formada divide a fibrina em produtos de degradação solúveis. A atividade da protease da plasmina é semelhante à da tripsina pancreática e é pouco específica (além do plasminogênio, também é ativa em outros substratos, como os constituintes do complemento plasmático, os fatores coagulativos V e VIII, o fibrinogênio e alguns hormônios da natureza proteína, como ACTH, glucagon e hormônio do crescimento). Da proteólise do fibrinogênio e da fibrina, originam-se fragmentos peptídicos de tamanhos variáveis, denominados complexos FDPs ( fibrinogênio e produtos de degradação da fibrina ).
Tal como na cascata de coagulação, também existem inibidores específicos para a cascata proteolítica. Na sua ausência, na verdade, produziria uma demolição exagerada de fibrinogênio, fibrina e outras proteínas importantes para a coagulação, com o risco de hemorragias graves.
Durante a formação do coágulo, a síntese de plasmina é geralmente inibida por substâncias específicas liberadas por plaquetas ativadas e por células locais. Somente na presença de fibrina ou estase devido à oclusão venosa, o endotélio libera uma quantidade excessiva de ativadores de plasminogênio, que se ligam a receptores específicos, resultando em fibrinólise. Enquanto nos outros locais do corpo os receptores de plasmina para os inibidores relativos (a antiplasmina) estão livres, ao nível do coágulo são envolvidos pela ligação com a fibrina; dessa maneira, a plasmina é protegida por sua ação e, portanto, é livre para realizar plenamente sua atividade.
Algumas drogas, como a estreptoquinase, aumentam a atividade fibrinolítica e, como tal, são úteis na hipercoagulabilidade do sangue (trombose). Por outro lado, existem também drogas antifibrinolíticas, particularmente úteis em pacientes com hemorragias de hiperfibrinólise.



