Proteínas ingeridas com alimentos são hidrolisadas no estômago e no intestino delgado para produzir aminoácidos livres e oligopeptídeos. Esses produtos são absorvidos pelas células do intestino delgado e despejados na corrente sanguínea; a maioria dos aminoácidos é então usada pelos vários órgãos e tecidos para processos de renovação celular (turnover proteico).
DEGRADAÇÃO DE AMINOÁCIDOS
Os aminoácidos sofrem degradação:
1) para o turnover de proteína normal
2) quando sua ingestão com a dieta é excessiva
3) na deficiência de carboidratos
O primeiro estágio do catabolismo de aminoácidos envolve a remoção do grupo amino. O esqueleto de carbono é assim usado no ciclo de Krebs ou na gliconeogênese.
Aminotransferases ou transaminases são as principais enzimas na remoção do grupo amino de aminoácidos.
As reações de transaminação consistem na transferência de um grupo amino de um dador de aminoácidos para o alfa-cetoglutarato para formar o glutamato. Durante esta reacção, o grupo amino dador é convertido em a-cetoacido. O glutamato transmite os grupos amino ao ciclo da ureia ou às vias biossintéticas dos aminoácidos.
A coenzima das transaminases é o piridoxalfosfato, uma enzima produzida a partir da piridoxina (vitamina B6).
As transaminações são reversíveis e podem funcionar nas duas direções, dependendo das necessidades da célula.
EXPANSÃO DE NIGOTE
Normalmente, o excesso de grupos amino é excretado ou usado para sintetizar compostos nitrogenados.
Um processo importante para os aminoácidos é a desaminação oxidativa. Ocorre na mitocôndria e é catalisada pela glutamato desidrogenase, uma enzima que afasta o grupo amino do glutamato e o substitui por oxigênio da água.
O íon de amônio que é formado reage com o glutamato para formar glutamina, que atua como um transportador de grupos amino para o fígado. A enzima que permite essa reação dependente de ATP é a glutamina sintase.
A glutamina entra na corrente sanguínea e chega ao fígado onde, dentro das mitocôndrias do fígado, é convertida de volta ao glutamato com a liberação do íon amônio NH4 +.
A alanina é o principal transportador de grupos amino do músculo para o fígado. É formado pela transferência do grupo amino do glutamato para o ácido pirúvico ou piruvato. Da mesma forma que acontece com a glutamina, uma vez que atinge a mitocôndria hepática, a alanina libera seu íon amônio, gerando glutamato e piruvato. O piruvato é necessário para o fígado no processo chamado gliconeogênese.
O íon amônio NH4 + é tóxico para as células do corpo e, em particular, para o cérebro. Como vimos, no sítio extra-hepático o íon amônio é neutralizado por ligação com glutamato ou piruvato. No fígado, o NH4 + é incorporado na molécula de ureia não tóxica. A uréia produzida pelo fígado é transportada através do sangue para os rins para excreção urinária.
O CICLO DA UIC
O ciclo da ureia começa com a formação de carbamilfosfato pela enzima carbamilfosfato sintase. Durante esta reação, duas moléculas de ATP são gastas.
As reações subsequentes do ciclo da uréia são mostradas na figura.
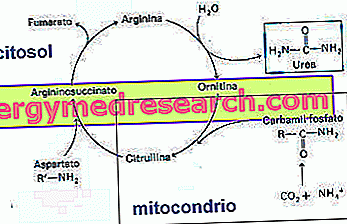
O ciclo da ureia requer uma quantidade elevada de energia (4 ATP para cada molécula de ureia produzida).
CATABOLISMO DO CARBONIOSO SCHELETRO DOS AMINOÁCIDOS
O esqueleto carbonoso dos aminoácidos é usado no ciclo de Krebs para produzir energia.

Como mostrado na figura, os esqueletos de carbono convergem em sete compostos capazes de entrar direta ou indiretamente no ciclo de Krebs: piruvato, acetilCoA, acetoacetilCoA, α-cetoglutarato, succinilCoA, fumarato, oxaloacetato.
Aminoácidos que são degradados para acetilCoA ou acetoacetilCoA são chamados cetogênicos e são os precursores de corpos cetônicos.
Os outros são glicogênicos e podem, uma vez convertidos em piruvato e oxaloacetato, formar glicose através da gliconeogênese.
Veja também: Aminoácidos, uma olhada na química
Proteína, uma olhada na química



