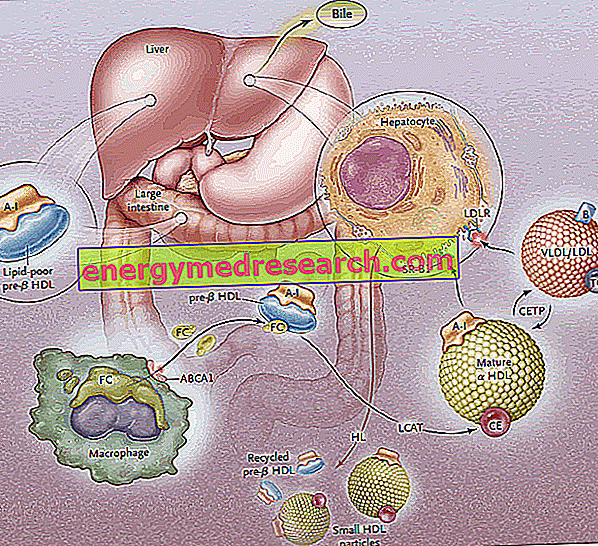
O transporte reverso do colesterol (RCT) é o processo pelo qual o colesterol é removido dos tecidos periféricos, através da sua incorporação nas lipoproteínas HDL e subsequente transporte para o fígado para excreção biliar.
As células periféricas, como todas as células não intestinais ou hepáticas, não são capazes de degradar o excesso de colesterol; portanto, para a manutenção da homeostase celular, a presença de um mecanismo dedicado à remoção do colesterol das células é essencial. Esse mecanismo, voltado para a recuperação hepática do excesso de colesterol periférico, é chamado de "transporte reverso do colesterol" (ECR: transporte reverso do colesterol ).
Vamos examinar o processo em detalhes.
A biossíntese das lipoproteínas HDL passa pela síntese e secreção inicial dos principais componentes protéicos (apoproteínas), seguida pela aquisição extracelular de lipídeos (fosfolipídios e colesterol), o que leva à montagem e geração de partículas HDL maduras.
O primeiro estágio do transporte reverso do colesterol consiste na produção, pelo intestino e pelo fígado, de precursores discóides da HDL, que expõem em sua superfície as apoproteínas (principalmente a ApoA-I); assim, são liberados precursores de HDL chamados pré-B-HDL, que incorporam quantidades muito pequenas de colesterol e lipídios, especialmente fosfolipídios. A presença dessas moléculas precursoras no nível periférico promove a transferência do excesso de colesterol livre (FC) - vazado das células dos tecidos periféricos - para a apo AI, através da intervenção de um transportador de membrana chamado cassete de ligação a ATP A1 (ABCA1 ). Este transportador está localizado na superfície celular e nas membranas do Golgi, e pode transportar lipídios do aparelho de Golgi para a membrana celular, facilitando seu efluxo. Neste ponto, assim que o colesterol livre entra no HDL nativo, uma enzima plasmática de origem hepática intervém, chamada aciltransferase de colesterol de lecitina no plasma ou mais simplesmente LCAT; esta enzima converte o colesterol livre incorporado em pré-B-HDL em ésteres de colesterol, transformando a pré-B-HDL na sua forma madura de α-HDL; na prática, a acumulação contínua de colesterol no núcleo da lipoproteína converte a HDL discóide em partículas esféricas e roliças, as quais podem ainda adquirir apoproteínas das partículas de lipoproteínas ricas em triglicerídeos e se misturar. Em todo o processo, a apolipoproteína AI desempenha um papel fundamental, estimulando a atividade do transportador ABCA1 e do LCAT. Como a ApoAI é a apolipoproteína mais amplamente representada no HDL, sua concentração plasmática está diretamente relacionada aos níveis de colesterol HDL.
NOTA: o processo de esterificação é essencial para evitar a redu- ção do colesterol da HDL para a membrana plasmática; este mecanismo explora o ácido gordo na posição dois presentes nas moléculas de fosfatidilcolina.
O processo de esterificação mediado por LCAT transforma as moléculas pré-B-HDL na sua forma esférica α-HDL "madura". Essas lipoproteínas são então transportadas para o fígado, onde liberam colesterol, de acordo com duas rotas distintas.
No primeiro caso, o HDL rico em colesterol esterificado leva este lipídio a lipoproteínas ricas em triglicérides (lipoproteínas de muito baixa e baixa densidade), então interceptadas pelo fígado por receptores específicos (LDL-R) e removidas da circulação. O objetivo é canalizar o colesterol periférico para o fígado através do sistema receptor de LDL, assim "baixando" o HDL do excesso de colesterol para o nível periférico, de modo a torná-lo disponível novamente para recebê-lo dos tecidos; esvaziado de colesterol, HDLs aceitam triglicerídeos em troca e isso é feito graças à proteína de transferência de colesterol éster (CETP). A tarefa desta proteína é, portanto, promover a redistribuição e o equilíbrio dos ésteres de colesterol e triglicérides entre os remanescentes de HDL, LDL, IDL, VLDL, quilomícrons e de quimonômeros, levando, como resultado líquido, a um enriquecimento triglicerídeos de HDL, em detrimento dos ésteres de colesterol, e uma redução no tamanho de HDL.
A segunda via envolve receptores hepáticos SR-B1 para HDL rico em colesterol esterificado, na ausência de degradação concomitante da porção protéica da HDL, que é então reciclada. Na prática, esta enzima permite esvaziar o HDL do seu conteúdo e regenerar o novo pré-B-HDL. Parte da HDL e da ApoA-I é internalizada e degradada ao nível dos lisossomas, tanto nas células hepáticas como nas renais. A captação mediada por SR-B1 torna-se mais eficiente pela atividade da lipase hepática, capaz de remodelar a HDL hidrolisando os fosfolipídios de superfície e permitindo o fluxo de colesterol esterificado pelo núcleo da lipoproteína em direção à membrana plasmática (hipoteticamente, entre outro, que também a ApoE está envolvida na captação seletiva, uma vez que camundongos deficientes para o gene da ApoE apresentam uma redução na eficácia desse caminho). O SR-BI é expresso predominantemente no fígado, adrenal e ovário.