generalidade
O mieloma múltiplo é um tumor maligno que afeta algumas células do sistema imunológico, causando danos a vários órgãos e tecidos. Geralmente se desenvolve em pessoas com mais de 50 anos e é freqüentemente acompanhada de dor, fraturas e destruição óssea.
O mieloma múltiplo é diagnosticado com testes de sangue e medula óssea, eletroforese de proteínas na urina e investigações radiológicas. As remissões da doença podem ser induzidas com esteróides, quimioterapia, inibidores do proteassoma, drogas imunomoduladoras (como a talidomida ou lenalidomida) e transplante de células-tronco.
causas
As causas que causam mieloma múltiplo são parcialmente desconhecidas. A partir das estatísticas médicas, descobriu-se que a incidência aumenta em indivíduos expostos a radiações ionizantes ou a determinadas substâncias químicas (derivados de petróleo e outros hidrocarbonetos, solventes, pesticidas, amianto, etc.). Fatores genéticos familiares, estimulação antigênica repetitiva e agentes virais também podem participar da etiologia do mieloma múltiplo.
Os sintomas
Para aprofundar: Sintomas do Mieloma Múltiplo
O mieloma múltiplo ocorre predominantemente na última idade (acima de 50 anos). Os sinais e sintomas podem variar muito de pessoa para pessoa, já que muitos órgãos podem estar envolvidos na doença. No início, a condição pode não causar sintomas. Com o progresso da doença, é provável que ocorram sintomas relacionados à infiltração de órgãos plasmocelulares e produção excessiva de imunoglobulinas monoclonais:
- Dores ósseas. A dor óssea afeta quase 70% dos pacientes com mieloma múltiplo e é o sintoma mais comum. Localiza-se principalmente ao nível da coluna vertebral, pélvis, costelas, ossos longos e crânio. A sintomatologia inicial é "pseudoreumática", enquanto uma dor aguda e persistente localizada pode indicar uma fratura óssea patológica. O envolvimento das vértebras pode levar à compressão da medula espinhal. No mieloma múltiplo, o dano ósseo é secundário ao aparecimento de lesões "líticas" e à osteopenia relacionada à proliferação de plasmócitos mielomatosos na cavidade medular. As células do mieloma múltiplo, de fato, produzem vários fatores (reunidos na denominação OAF, Fator Ativador de Osteoclastos) que permitem aos osteoclastos acelerar a demolição do tecido ósseo, através da reabsorção. Como os osteoblastos ("produtores de osso") não sofrem o mesmo estímulo proliferativo, a massa óssea diminui progressivamente. Isso altera a estrutura do tecido, tornando os ossos frágeis e propensos a fraturas, osteoporose e esmagamento (vértebras). Do ponto de vista radiológico, o rearranjo ósseo é evidente para o aparecimento de manchas "perfuradas", que coincidem com as áreas em que a osteocondensação está ausente. O aumento das lesões ósseas também pode aumentar a liberação de cálcio no sangue (hipercalcemia).
- Hipercalcemia . Um alto nível de cálcio no sangue afeta a função dos nervos e causa sede excessiva, náusea, constipação, perda de apetite e confusão mental. A hipercalcemia é devida à infiltração de células malignas nos ossos.
- Insuficiência renal. Vários fatores intervêm no condicionamento da função renal. Níveis elevados de imunoglobulinas <Anormais monoclonais (proteínas <M), podem causar lesões tubulares devido à sua deposição nos glomérulos (proteinúria de Bence Jones). O aumento da reabsorção óssea leva à hipercalcemia e causa nefrocalcinose, contribuindo para a insuficiência renal. Outras causas incluem nefropatia hiperuricêmica (deposição de ácido úrico), infiltração local de células tumorais, infecções recorrentes (pielonefrite) e amiloidose.
- Anemia. No mieloma múltiplo, a deficiência de glóbulos vermelhos deriva da falta de produção de células sanguíneas "saudáveis" em favor de clones tumorais na medula óssea. Anemia pode levar a astenia, fraqueza geral e dificuldade em respirar.
Esses quatro problemas, comuns ao mieloma múltiplo, são frequentemente referidos pela sigla CRAB, que se refere aos níveis de cálcio, insuficiência renal, anemia e dano ósseo → C = cálcio (elevado), R = insuficiência renal, A = anemia, B = Lesões ósseas
Outros sinais e sintomas do mieloma múltiplo podem incluir:
- Infecções : a redução de glóbulos brancos (leucopenia) leva à imunodeficiência, portanto, a uma menor resistência a infecções. Estes podem ser de gravidade clínica diferente (pneumonia, sinusite, infecções de pele, bexiga ou rim) e representam a principal causa de morte de pacientes com mieloma múltiplo. O período de maior risco para a ocorrência de infecções inclui os meses iniciais após o início da quimioterapia.
- Distúrbios da hemostase : a deficiência de plaquetas (trombocitopenia) leva a alterações no processo de coagulação, que se manifesta como uma tendência marcada a sangrar. Em geral, a meia-vida das plaquetas é reduzida e a interação com o endotélio vascular é alterada. Outras anormalidades na hemostasia resultam da redução da fibrinólise.
- Síndrome de hiperviscosidade : em alguns casos de mieloma múltiplo, observa-se um aumento na viscosidade plasmática, resultando em sintomas hemorrágicos, distúrbios neurológicos e isquemia coronariana.
- Distúrbios neurológicos : as manifestações neurológicas associadas ao mieloma múltiplo são heterogêneas. O aparecimento de dores nevríticas e fraqueza ou dormência nos membros são os sintomas mais comuns. Finalmente, pode haver dor nas raízes e compressão da medula espinal devido ao envolvimento vertebral, ou síndrome do túnel do carpo e outras neuropatias causadas pela infiltração de depósitos de amilóide no nível dos nervos periféricos.
diagnóstico
O médico pode detectar sinais de mieloma múltiplo através de exames de sangue e urina realizados durante um exame físico de rotina. Se o paciente estiver assintomático, esses exames laboratoriais podem ser repetidos regularmente, a fim de monitorar a evolução da doença e determinar o melhor momento para iniciar o tratamento. O envolvimento de órgãos é um importante critério diagnóstico para o mieloma múltiplo.
Exames laboratoriais
Em muitos casos, o teste hemocromocitométrico estabelece a presença de anemia (Hb <10g / dl). O esfregaço de sangue periférico torna possível detectar glóbulos vermelhos empilhados (rouleaux), uma consequência do aumento da viscosidade do plasma. Muitas vezes, a neutropenia e trombocitopenia coexistem, que pioram nos estágios terminais da doença.
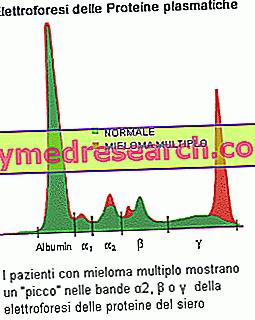
A eletroforese de proteínas séricas é capaz de demonstrar a presença de paraproteínas produzidas pelo clone tumoral: a suspeita de mieloma é fundamentada se a banda (pico) for relevante no perfil eletroforético, com componente M> 30 g / L. Outro achado comum é a proteinúria de Bence Jones, caracterizada pela presença na urina de paraproteínas consistindo de cadeias leves do tipo monoclonal. As medidas quantitativas do componente M são necessárias para estabelecer um diagnóstico de mieloma múltiplo e monitorar a doença. Os testes sanguíneos estabelecem um aumento na taxa de sedimentação eritrocitária (VHS) e determinam alterações nos níveis de cálcio (elevados em pessoas com mieloma múltiplo avançado), albumina (baixos níveis correlacionados com mieloma avançado), ácido úrico (uricemia) e creatinina devido à redução da função renal). O médico também pode realizar outros testes para verificar a presença de beta-2-microglobulina, outra proteína produzida por células plasmáticas mielomatosas. Este pode ser um indicador útil no estadiamento de um paciente: altos níveis indicam uma doença mais avançada e um pior prognóstico.
Técnicas de imagem
O levantamento radiológico mostra o envolvimento do esqueleto. A ressonância magnética é mais sensível que a radiografia convencional na detecção de lesões líticas e é capaz de pré-definir a presença de rearranjos ósseos.
Exame da medula óssea
O exame da medula óssea destaca uma série de plasmócitos: um requisito diagnóstico para a definição de mieloma múltiplo requer que a quantidade de clones tumorais seja superior a 10%. Uma porção da amostra também é testada para avaliar a presença de alterações características no cariótipo, seja por citogenética convencional ou pelo uso de técnicas de hibridização fluorescente in situ (FISH). As anormalidades cromossômicas mais freqüentemente encontradas no mieloma múltiplo afetam os cromossomos 1, 3, 5, 11, 13 e 14. Em particular, a monossomia do cromossomo 13 se correlaciona com uma sobrevivência reduzida, associada a uma alta taxa de proliferação e resistência a drogas.
Encenação e prognóstico
Investigações diagnósticas podem confirmar o quadro clínico do mieloma múltiplo. Além disso, os resultados desses testes permitem ao médico classificar a doença nos estágios 1, 2 ou 3. As pessoas com mieloma estágio 3 apresentam um ou mais sinais de doença avançada, incluindo um maior número de clones tumorais e insuficiência renal. Além disso, o resultado da biópsia da medula óssea permite ao médico determinar o perfil geral de risco do paciente e desenvolver o melhor plano terapêutico.
| Estadiamento do mieloma múltiplo (segundo Durie-Salmon) | ||
| Estágio clínico | parâmetros | Massa tumoral (número de células) |
| Estágio 1 | Todos os itens a seguir:
| <0, 5x1012 / m2 |
| Estádio 2 | Nenhum dos critérios dos estágios I e III | 0, 5-1, 2x1012 / m2 |
| Estágio 3 | Um ou mais dos seguintes procedimentos:
| > 1, 2x1012 / m2 |
Os estágios 1, 2 e 3 do sistema de estadiamento de Durie-Salmon podem ser subdivididos em A ou B, dependendo da creatinina sérica:
- A: creatinina <2 mg / dl (<177 mmol / l)
- B: creatinina sérica> 2 mg / dl (> 177 micromoles / L)
Recentemente, outro sistema de classificação chamado International Multiple Staging System foi proposto.
Índice internacional de prognóstico para mieloma (publicado pelo International Staging System - 2005) | ||
estádio | critérios | Sobrevida média (meses) |
o |
| 62 |
II | h42-microglobulina <3, 5 mg / L e albumina <3, 5 g / dl ou β2-microglobulina 3, 5-5, 5 mg / L independentemente da albumina sérica | 44 |
III | β2-microglobulina ≥ 5, 5 mg / l | 29 |
tratamento
Para mais informações: Medicamentos de mieloma múltiplo
O tratamento do mieloma múltiplo é focado em terapias que reduzem a população clonal. Se a doença é completamente assintomática, o manejo é limitado à observação clínica. Na presença de sintomas, o tratamento pode ajudar a aliviar a dor, controlar as complicações, estabilizar a condição e retardar a progressão do tumor.
Terapia de primeira linha
Nos últimos anos, a quimioterapia em altas doses com o transplante autólogo de células-tronco hematopoiéticas (autotransplante) tornou-se a opção de tratamento mais apropriada para pacientes com menos de 65 anos. Antes do autotransplante, um ciclo inicial de quimioterapia de indução é administrado, capaz de reduzir a massa neoplásica. Os esquemas mais utilizados envolvem a administração de talidomida (+ dexametasona), bortezomibe e lenalidomida (+ dexametasona). O tratamento com altas doses de quimioterapia e suporte de células-tronco (autotransplante) não é curativo, mas pode prolongar a sobrevida global e resultar em remissão completa. O transplante alogênico de células-tronco, isto é, de uma pessoa saudável para o paciente afetado, representa um potencial de cura, mas está disponível apenas para uma pequena porcentagem de casos clínicos. Pacientes com mais de 65 anos de idade e com doença concomitante significativa geralmente não toleram o transplante de células-tronco. Para essas pessoas, muitas vezes, o tratamento padrão envolve a quimioterapia com melfalano (por 4-7 dias) associada à prednisona (5-10 dias), em ciclos repetidos a cada 6 semanas, seguidos por um período de descanso. Em alguns pacientes, a associação desse protocolo com novos esquemas terapêuticos, que incluem, por exemplo, a administração de bortezomibe, pode ser útil. Este fármaco é um inibidor de proteassoma (um complexo multiproteico presente em todas as células), o que permite respostas clínicas completas a serem alcançadas em pacientes com doença refratária ou que progride rapidamente. O mecanismo de ação do bortezomibe baseia-se na indução de apoptose em células tumorais, bloqueando a ação dos proteossomas. Uma resposta clínica significativa é encontrada em cerca de 50% dos casos
Terapia de suporte
Além do tratamento direto do mieloma múltiplo, os bisfosfonatos (por exemplo, pamidronato ou ácido zoledrônico) são rotineiramente administrados para controlar lesões líticas e prevenir fraturas ósseas. Transfusões baseadas em hemácias e eritropoetina são úteis na correção de sintomas associados à anemia, enquanto a administração de concentrados de plaquetas pode prevenir o sangramento causado por trombocitopenia. Os esteróides e bisfosfonatos também desempenham um papel importante no tratamento de crises hipercalcêmicas, enquanto os antibióticos auxiliam no manejo de infecções.



